
Vacara是一家瑞典公司,致力于开发新型类风湿性关节炎诊断试剂盒、创新的预防和治疗方法。产品包括:诊断试剂盒、疫苗研究产品、保护性抗体以及人源化动物模型和用于诱导设计的免疫反应和诱导T细胞介导的关节炎的抗原(Cag1、Cag2、Cag3、Cag4、Cag5)。
特色产品:
软骨寡聚基质蛋白(COMP)诱导C57BL/6的小鼠关节炎
背景简介:转基因小鼠研究常用的品系是C57BL/6遗传背景小鼠,由于缺乏该品系的类风湿关节炎(RA)可靠模型而限制了该品系在风湿病研究中的的应用。胶原诱导的关节炎(CIA)是最广泛的类风湿关节炎动物模型,而
C57BL/6小鼠由于具有MHC II类单倍型H-2b,其不能有效用于制备胶原诱导的关节炎(CIA)模型。
瑞典Vacara公司开发了一种用软骨寡聚基质蛋白(COMP)诱导C57BL/6小鼠关节炎模型。该蛋能够在C57BL/6小鼠诱导高发病率的严重关节炎,并伴有强烈的自身抗体反应。
关键词:瑞典Vacara
,类风湿性关节炎、软骨寡聚基质蛋白(COMP)、Cartilage Oligomeric Matrix Protein
、C57BL/6小鼠,转基因
实验动物:COMP诱导的关节炎可以在雄性和雌性小鼠中都可以进行。如果使用雌性小鼠,应该讲它们放在一起一段时间,以同步它们的发情周期。如果使用雄性小鼠,特别重要的一点是在性成熟之前将其分组以避免相互攻击。
在实验中,所有小鼠必须年龄和性别匹配,随机分为实验组,实验组混合在在笼中。用于造模的小鼠至少要9周龄。小鼠在标准饲养条件下饲养,优先选择SPF饲养设施,该设施具有12小时明暗循环的气候控制环境,饲养在具有标准食物和随意给水的笼中。实验也在传统动物房进行,但是所有的可变条件(感染、通风、光循环、喂养等)都需要详细描述,因为这些条件变化可能会影响实验结果。
模型诱导方案:关节炎模型通过COMP 免疫小鼠诱导。将COMP(100ug/小鼠)与佐剂(CFA, #263810, BD Difco)或含有结核杆菌(0.5mg/ml)的CFA 1:1 等体积混合制备乳剂。制备乳剂最终100ul乳剂中含COMP 100ug。
| 初次免疫(0天) |
每只小鼠尾根部皮内免疫100ul 乳剂(COMP和CFA(0.5mg/ml)配置的乳剂,含100ug COMP) |
| 加强免疫(35天) |
每只小鼠尾根部皮内免疫50ul乳剂(COMP和IFA)配置的乳剂,含50ug COMP。 |
初次免疫佐剂选择(CFA或IFA)可能会影响疾病的严重程度。相对含有结核杆菌的(Mycobacterium Tuberculosis H37Ra)IFA,CFA(2mg/ml M.butyricum)会导致更严重的炎症。不管初次免疫的佐剂如何选择,预计的发病时间都是相同的。加强免疫后预计出现更严重的炎症(
见图1)。环境因素如小鼠的微生物菌群变化,可能会影响疾病的严重程度,可以通过选择适合环境和实验目的的佐剂来控制。
关节炎评分:初次免疫2周开始,每周至少对小鼠进行三次外周关节炎症查看。对爪子关节炎的症状随机观察,对每个红肿关节进行盲评分。要定义为临床关节炎,必须满足两个标准,即肿胀和发红。因此,例如在活动性关节炎后仍然肿胀但不载观察到红斑的爪子不被评分或不认为是关节炎。
临床关节炎的评分结果是0-60分:根据关节炎疾病的严重程度,每只发炎的足趾或关节得1分,脚腕或脚踝发炎得1-5分,每只爪子得0-15分,每只小鼠最多得60分。典型的严重过程如图1.所示。
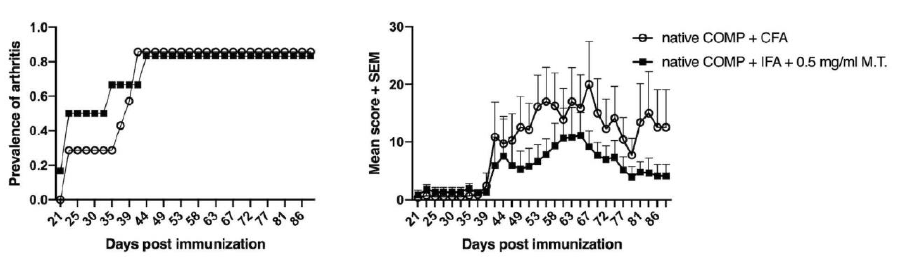
图1.COMP诱导C57BL/6小鼠具有高发病率和严重程度的关节炎。小鼠用COMP+CFA佐剂(n=7)或IFA+0.5mg/ml结核杆菌(n=6)免疫,第35天加强免疫。关节炎发病率(左侧)和关节炎评分(右侧)。
COMP诱导的关节炎特征:与人关节炎相似,COMP诱导的关节炎导致关节炎关节中显著的滑膜增生、炎症细胞浸润及软骨和骨破坏。COMP诱导的关节炎导致显著的抗COMP IgG, IgG1,IgG2b自身抗体反应,与首次免疫使用的佐剂无关。在C57BL/6小鼠中,未观察到显著的抗II型胶原抗体反应,这表明COMP特异性B细胞反应。COMP反应似乎是肽特异性的,因为很少有肽被认为主要的自身抗体表位。
COMP仅以天然构象诱导严重的临床关节炎。变性的COMP免疫,只能导致轻微的关节炎,发病率低。然而,这良好总构象都诱导抗COMP抗体反应,但当天然COMP用于免疫时,观察到更强的抗COMP IgG、IgG1和IgG2b抗体反应。结论是:构象表位的抗体是致病性的,可以诱导关节炎,并且这些抗体可能是由COMP特异性细胞协助激发的。
检测方法:关节炎发生后,可以在苏木精和伊红染色后对关节炎急性组织学分析。抗COMP的血清抗体可以通过ELISA法测定,使用重组人COMP作为测定抗原。操作流程,用于检测IgG,IgG1和IgG2b系列抗体及在C57BL/6小鼠典型结果在文献3种有详细描述。肽特异性T细胞活化可通过体外刺激脾细胞并通过ELISpot测定IFN-γ 分泌来测量,如文献3所述。
优势:COMP在C57BL/6小鼠中诱导的关节炎与类风湿性关节炎小鼠模型CIA有许多相似之处,能够诱发严重的多发性关节炎。该炎症于MHCII类分子相关,T细胞识别的COMP衍生肽已被证实。与CIA一样,T细胞对非自身蛋白抗原的反应促进了关节炎的诱导,因为免疫优势肽不能很好的与MHC II类分子结合,因此不能诱导耐受性。COMP免疫诱导强烈的抗体反应,类似CIA中的II型胶原。
COMP诱导的关节炎的主要优点是:可以在携带H-2b单倍型的C57BL/6小鼠中诱导严重的关节炎。C57BL/6小鼠被认为是免疫学研究的标准背景,并且大多数转基因小鼠株都是在这个背景下建立的。对于COMP诱导的关节炎,遗传修饰的C57BL/6小鼠可用于关节炎实验,而无需广泛的回交。
COMP也可以诱导C3H背景表达A
q, A
p小鼠。因此,COMP诱导的关节炎在许多小鼠品系中可用于研究关节炎,并且免疫反应与人类RA直接相当。COMP诱导的小鼠关节炎在雌性和雄性中都是可诱导的。此外,COMP可以诱导大鼠关节炎,与LEW,E3 或DA 背景的RT1u MHC单倍型相关。
局限性: COMP诱导的关节炎在加强免疫后会诱发严重的关节炎,因此需要几周的时间来实验。另一方面,这种特征被认为是一种优势,因为该疾病模型与人类风湿性关节炎具有相同的免疫特征和T细胞和B细胞依赖性机制。
产品订购:
| 品牌 |
货号 |
产品名称 |
规格 |
| Vacara |
Native Cartilage Oligomeric Matrix Protein, recombinant human (rhCOMP) |
10020 |
1mg |
相关产品:
| 品牌 |
货号 |
产品名称 |
规格 |
| Vacara |
10110 |
Mouse Anti col2A1 Antibody (M2139) |
100µg/0.1mL |
| Vacara |
10130 |
Mouse Anti citrullinated COL2A1 Antibody (ACC1) |
100µg/0.1mL |
| Vacara |
10120 |
Mouse Anti-Collagen XI Antibody (L10D9) |
100µg/0.1mL |
| Vacara |
10150 |
Mouse Anti- Cartilage Oligomeric Matrix Protein Antibody (16B5) |
100µg /0.1mL |
| Vacara |
10030 |
Cartilage Antibody Cocktail (Cab3) |
1kit |
| Vacara |
10040 |
Cartilage Antibody Cocktail (Cab4) |
1kit |
| Vacara |
10020 |
Native Cartilage Oligomeric Matrix Protein, recombinant human (rhCOMP) |
1mg |
| Vacara |
10140 |
Mouse Anti- Cartilage Oligomeric Matrix Protein Antibody (15A11) |
100µg/0.1mL |
参考文献1. Holmdahl R, Andersson M, Goldschmidt TJ, Gustafsson K, Jansson L, Mo JA. Type II collagen autoimmunity in animals and provocations leading to arthritis. Immunol Rev. 1990;118:193-232.
2. Bäcklund J, Li C, Jansson E, Carlsen S, Merky P, Nandakumar KS, et al. C57BL/6 mice need MHC class II Aq to develop collagen-induced arthritis dependent on autoreactive T cells. Ann Rheum Dis. 2013;72(7):1225-32.
3. Zhao Y, Urbonaviciute V, Xu B, Cai W, Sener Z, Ge C, et al. Cartilage Oligomeric Matrix Protein Induced Arthritis-A New Model for Rheumatoid Arthritis in the C57BL/6 Mouse. Front Immunol. 2021;12:631249.
4. Holmdahl R, Carlsen S, Mikulowska A, Vestberg M, Brunsberg U, Hansson A-S, et al. Genetic analysis of murine models for rheumatoid arthritis. In: Adolpho KW, editor. Human Genome Methods. New York: CRC press; 1998. p. 215-38.
5. Geng H, Nandakumar KS, Pramhed A, Aspberg A, Mattsson R, Holmdahl R. Cartilage oligomeric matrix protein specific antibodies are pathogenic. Arthritis Res Ther. 2012;14(4):R191.
6. Malmström V, Michaëlsson E, Burkhardt H, Mattsson R, Vuorio E, Holmdahl R. Systemic versus cartilage-specific expression of a type II collagen-specific T-cell epitope determines the level of tolerance and susceptibility to arthritis. Proc Natl Acad Sci U S A. 1996;93(9):4480-5.
7. Hultqvist M, Bäcklund J, Bauer K, Gelderman KA, Holmdahl R. Lack of Reactive Oxygen Species Breaks T Cell Tolerance to Collagen Type II and Allows Development of Arthritis in Mice. J Immunol. 2007;179(3):1431-7.
8. Carlsen S, Nandakumar KS, Backlund J, Holmberg J, Hultqvist M, Vestberg M, et al. Cartilage oligomeric matrix protein induction of chronic arthritis in mice. Arthritis Rheum. 2008;58(7):2000-11.
9. Carlsén S, Hansson AS, Olsson H, Heinegård D, Holmdahl R. Cartilage oligomeric matrix protein (COMP)-induced arthritis in rats. Clin Exp Immunol. 1998;114(3):477-84.
更多产品订购,请联系瑞典Vacara 中国区总代理北京博蕾德生物科技有限公司。






